Acromegalia: dal Congresso CUEM buone notizie in ambito terapeutico. Nel corso dell’evento anche un focus sulle comorbilità associate alla malattia
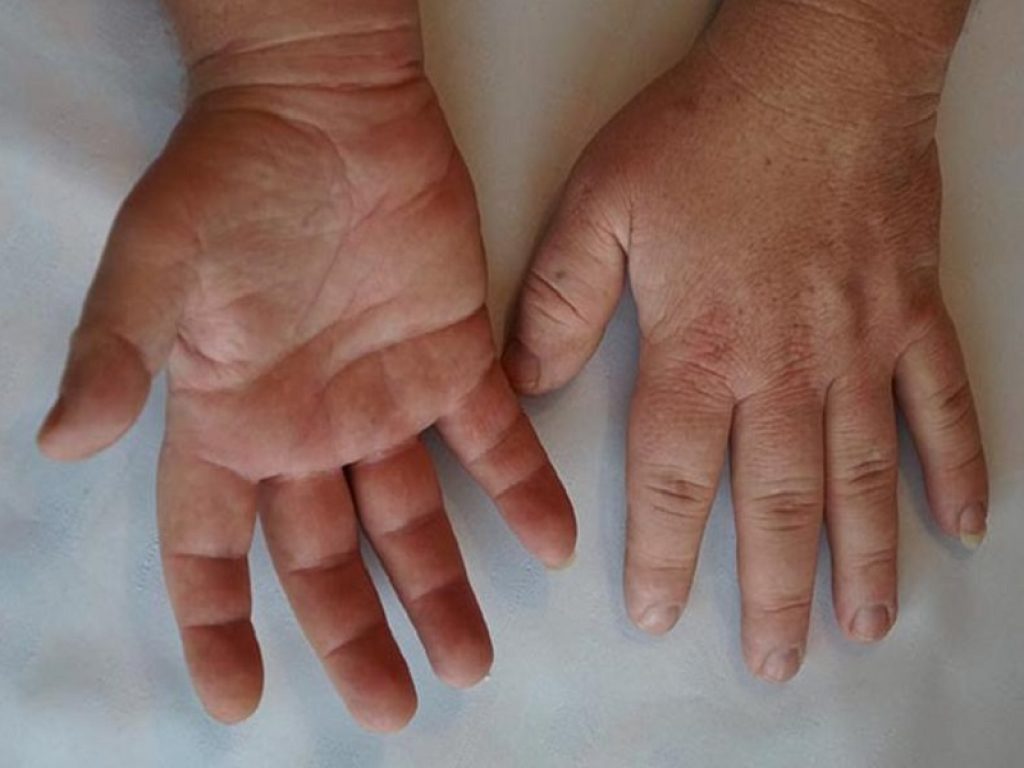
Un’onda anomala di ormone della crescita, quel GH che viene secreto in maniera incontrollata in caso di tumore (l’adenoma ipofisario). L’acromegalia è il risultato di una tempesta perfetta di ormoni che si riversano in circolo e influiscono su tessuti molli e estremità (come mani, avambracci, piedi e cranio) e che rendono l’aspetto estetico caratteristico: viso allungato, prognatismo della mascella, mani e piedi grandi.
La patologia è caratterizzata da numerose comorbilità, come ipertensione, disturbi respiratori di tipo ostruttivo, alterazioni della vista e disturbi muscolo-scheletrici (fratture vertebrali sono state osservate in più del 60% dei soggetti), sino alla paralisi del nervo cranico a causa della pressione esercitata dalla massa tumorale. E non va meglio sul fronte metabolico, caratterizzato da insulino-resistenza che prelude a quadri di diabete, ed elevati valori di emoglobina glicata (quella che indica la quantità di glucosio legato all’emoglobina), marker predittivo di disturbi cardiovascolari.
I trattamenti sono quindi orientati a normalizzare i livelli di GH e IGF-1, migliorare i sintomi e la qualità di vita e ridurre la mortalità. Purtroppo, il controllo ormonale dopo l’asportazione del tumore è un obiettivo raggiunto in meno del 65% dei pazienti e solo il 50% di quelli sottoposti a terapia medica possono vantare il controllo dei valori di IGF-1. Valori inferiori a 1 microgrammo/litro sono stati correlati a miglioramenti a lungo termine e mortalità ridotta dopo la chirurgia. E proprio questo valore è riconosciuto come il miglior indicatore di controllo della malattia. Obiettivo fondamentale anche la riduzione del volume del tumore, la cui dimensione, quando supera i 10 mm, è associata ad esiti peggiori.
“Al momento, l’utilizzo di molecole della classe degli analoghi della somastostatina consente una riduzione del volume tra il 20 e il 25%”, spiega il Professor Andrea Giustina, Presidente della Società Europea di Endocrinologia e Presidente CUEM (Clinical Update in Endocrinologia e Metabolismo). “Nonostante le sfide poste da un quadro clinico oggettivamente complesso, rispetto a qualche anno fa abbiamo un discreto armamentario terapeutico, che possiamo impiegare sia su coloro che hanno una persistenza della malattia nonostante la chirurgia, sia su quelli esclusi dalla chirurgia”.
Gli analoghi della somatostatina (SRL) ocreotide, lanreotide e pasireotide, così come la cabergolina (un agonista della dopamina), si legano ai recettori dell’adenoma e interrompono così la secrezione di ormone della crescita. Mentre l’antagonista diretto del GH, il pegvisomant, mette un freno alla produzione di IGF-1. “Con gli analoghi di prima generazione – prosegue Giustina – si otteneva un controllo dei parametri biochimici dal 25 al 45% con le versioni a lento rilascio (che prevedono una somministrazione mensile) sino al 55%, mentre con il pasireotide LAR abbiamo constatato un controllo che arriva al 70%”.
Ecco allora che la gestione della malattia deve prevedere la messa in campo di un team di specialisti adeguatamente preparati. La Consensus del 2017 sulla patologia si è focalizzata proprio sugli aspetti di gestione clinica: dal trattamento in centri in cui l’esperienza nei tumori pituitari sia consolidata alla normalizzazione dei livelli ormonali come primo obiettivo a cui tendere.
Tra le molecole disponibili, il pasireotide a rilascio prolungato (PAS-LAR) è un farmaco ligando multi recettore della somatostatina di seconda generazione, approvato per il trattamento dell’acromegalia. Precedenti ricerche hanno evidenziato che la molecola permette un efficace controllo dell’ormone della crescita e dei livelli di IGF-1 (Insuline Like Growth Factor), oltre a ridurre le dimensioni del tumore pituitario in pazienti che non rispondono agli agonisti della somatostatina di prima generazione. Un recentissimo articolo pubblicato su The Lancet del 4 aprile scorso, ha confermato i risultati del PAPE Study, che ha indagato l’efficacia e la sicurezza del passaggio (switch) alla molecola di nuova generazione nei pazienti già in trattamento con gli antagonisti del GH (pegvisomant).
Lo studio ha sorpreso i ricercatori quando hanno osservato che il nuovo trattamento determinava un aumento dell’intensità del segnale T2 alla risonanza magnetica (un indicatore di necrosi tumorale, degenerazione della massa o entrambe). Miglioramento avvenuto nel 30% (14) dei 47 pazienti esaminati, con un incremento sostanziale (superiore al 50%) in 8 di essi, che sostiene un effetto antitumorale del trattamento. Effetto che è stato riscontrato anche in 10 su 47 soggetti a 9 mesi dal trattamento e in 4 dopo la fine della ricerca. Ma anche a studio concluso, il segnale tipo 2 rimaneva elevato (1,42) rispetto al valore basale misurato all’inizio del trial (1,26). Inoltre, 14 pazienti che mostravano un miglioramento dell’adenoma hanno apprezzato una rilevante diminuzione dei livelli di IGF-1, uno dei fattori di rischio delle numerose patologie concomitanti (comorbilità) che contribuiscono a rendere complessa la vita dei pazienti.
Quali sono le principali implicazioni di queste nuove evidenze? “Questi risultati possono cambiare la gestione clinica della malattia in due direzioni”, precisa il professor Giustina. “L’uso della molecola nella fase pre-operatoria, allo scopo di diminuire la massa tumorale operabile, in alternativa potrebbe ridurre l’attività della malattia e alleviarne i sintomi. Di certo, queste osservazioni dovranno essere confermate e consolidate da adeguate indagini istologiche”.