Prurigo nodularis: serlopitant in monosomministrazione orale non ha raggiunto l’endopoint primario in due studi di fase III: stop alla sperimentazione
Nei pazienti affetti da prurigo nodularis, l’antagonista del recettore NK1 serlopitant in monosomministrazione orale non ha raggiunto l’endopoint primario in due studi di fase III, con conseguente interruzione delle sperimentazioni in questa patologia.
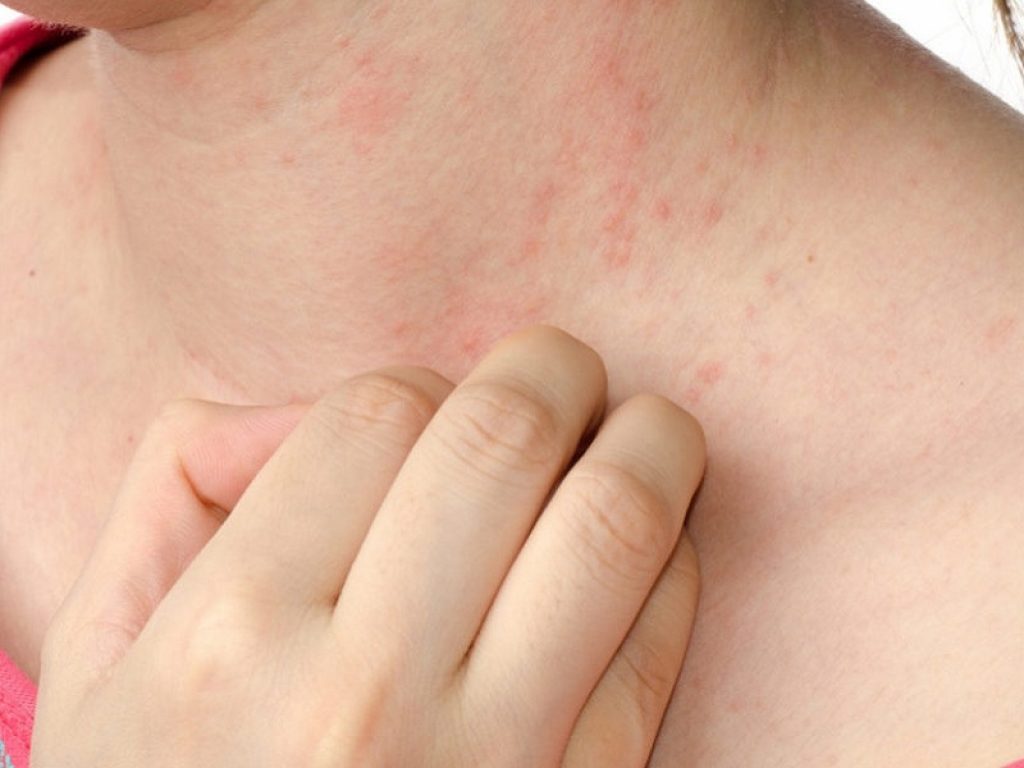
Il prurigo nodularis è una malattia cutanea che provoca la formazione di noduli duri e pruriginosi sulla pelle. Il prurito può essere così intenso che alcuni pazienti si grattano fino a sanguinare o provocarsi dolore, oltre a causare potenzialmente la formazione di ulteriori noduli se la pelle viene escoriata. Nonostante il suo nome, la malattia non provoca solo prurito, ma anche bruciore e dolore nell’area interessata, con un impatto decisamente negativo sulla qualità di vita dei pazienti.
Serlopitant è un antagonista a piccola molecola altamente selettivo del recettore NK1 (o recettore 1 della neurochinina), la cui attivazione trasmette al cervello la sensazione di prurito e stimola l’impulso a grattarsi. Ad esso si legano i peptidi appartenenti alla famiglia delle tachichinine (come la sostanza P), che svolgono numerose funzioni a livello del sistema nervoso e di quello immunitario.
Al momento non ci sono farmaci approvati specificamente per la cura del prurito cronico e molti trattamenti hanno scarsa efficacia o possono essere associati a effetti collaterali rilevanti. Secondo le linee guida europee del 2019 per il trattamento del prurito cronico, il primo approccio per gestire il sintomo consiste nel ridurre lo stimolo a grattarsi, mantenendo bassa la temperatura ambientale e applicando sostanze emollienti e farmaci topici come i corticosteroidi, gli inibitori della calcineurina e la capsaicina.
Meglio del placebo, ma senza significatività
In entrambi gli studi l’endpoint primario era una riduzione statisticamente significativa del prurito rispetto al placebo sulla base di un miglioramento di 4 punti nella worst-itch numeric rating scale (WI-NRS). Nello studio MTI-105, il 26,54% dei pazienti trattati con serlopitant ha raggiunto l’obiettivo alla settimana 10 rispetto al basale, rispetto al 20,31% dei soggetti nel gruppo placebo.
Nel secondo studio, chiamato MTI-106, alla settimana 10 ha raggiunto un miglioramento di almeno 4 punti nella scala WI-NRS rispetto al basale il 25,90% dei soggetti sottoposti alla terapia con serlopitant, contro il 18,95% nel gruppo placebo.
«Abbiamo intrapreso un solido programma di fase III per studiare serlopitant come potenziale trattamento per il prurito associato al prurigo nodularis», ha dichiarato David Domzalski, Ceo della biotech Menlo Therapeutics, la compagnia con sede a Bridgewater, New Jersey, che sta studiando il farmaco. «Anche se i dati hanno mostrato una superiorità del farmaco rispetto al placebo nell’endpoint primario, la differenza non era statisticamente significativa».
Stop allo sviluppo nel prurigo nodularis
Domzalski ha aggiunto che la società avrebbe analizzato a fondo i dati per ottenere una migliore comprensione dei risultati, ma ha ammesso di non avere intenzione di proseguire con gli studi sul farmaco. L’ esito delle sperimentazioni è sicuramente stata una grande delusione e una mancata opportunità commerciale per Menlo, dal momento che si stima che siano circa due milioni le persone solo negli Stati Uniti che soffrono di prurito cronico auto-riferito di origine sconosciuta (CPUO), definito come prurito della durata di sei settimane o più.
L’intenzione dell’azienda è di continuare a costruire il suo franchising in dermatologia ed espandere la sua pipeline. «All’inizio dell’anno abbiamo lanciato la minociclina per il trattamento per l’acne da moderata a grave e siamo molto incoraggiati dall’accoglienza positiva ricevuta finora da parte sia dei medici che dei pazienti. FMX103, la nostra schiuma a base di minociclina all’1,5% per il trattamento della rosacea papulopustolare, è attualmente in fase di revisione presso la Fda e le è stata assegnata la data del prossimo 2 giugno per il Prescription Drug User Fee Act (PDUFA). Se verrà approvata, sarà il nostro secondo lancio commerciale nel 2020» ha commentato.
Menlo ha in corso anche una sperimentazione di fase II per FCD 105, un prodotto che combina minociclina e il retinoide adaptalene, che dovrebbe a breve fornire una prima serie di dati.