Psoriasi a placche: Bristol Myers Squibb annuncia i nuovi dati a lungo termine di deucravacitinib che mostrano l’efficacia clinica mantenuta fino a due anni
Bristol Myers Squibb annuncia i nuovi risultati a due anni dello studio di estensione a lungo termine POETYK PSO (LTE) che dimostrano come l’efficacia clinica sia mantenuta con il trattamento continuo con deucravacitinib nei pazienti adulti con psoriasi a placche da moderata a severa. L’analisi ha valutato i pazienti dello studio principale POETYK PSO-1 che sono passati allo studio LTE. A 112 settimane di trattamento con deucravacitinib, i tassi di risposta modificati per imputazione dei non-responder (mNRI) erano dell’82,4% per PASI (Psoriasis Area and Severity Index) 75, del 55,2% per PASI 90 e del 66,5% per sPGA (static Physician’s Global Assessment) 0/1.
Questi dati (Presentation #D3T01.1F), oltre ad altri 25 abstract che dimostrano il grande impegno di Bristol Myers Squibb nella ricerca in dermatologia, sono stati presentati al Congresso della European Academy of Dermatology and Venereology (EADV), che si è svolto dal 7 al 10 settembre 2022.
“La realtà che stiamo osservando è che sia i dermatologi che i pazienti con psoriasi hanno identificato la necessità di terapie orali più efficaci e tollerabili, poiché la psoriasi è una malattia cronica sistemica immuno-mediata associata a gravi comorbidità”, ha affermato il Dr. Mark Lebwohl, MD, Dean of Clinical Therapeutics del Kimberly and Eric J. Waldman Department of Dermatology presso la Icahn School of Medicine, Mount Sinai (New York); il Dr. Lebwohl è anche un membro del Publication Steering Committee di questo studio. “Questi nuovi risultati a lungo termine, che mostrano un’efficacia duratura fino a due anni del trattamento continuo, supportano ulteriormente l’utilizzo di deucravacitinib una volta al giorno nei pazienti con psoriasi a placche da moderata a severa, e rispondono alla necessità di opzioni terapeutiche orali più efficaci”.
Dei 262 pazienti trattati con deucravacitinib, 171 hanno raggiunto PASI 75 alla settimana 16 dello studio POETYK PSO-1 e, tra questi pazienti, l’efficacia è stata mantenuta fino a 112 settimane, compresi i tassi di risposta PASI 75 (Settimana 16, 100%; Settimana 52, 90,1%; Settimana 112, 91,0%), PASI 90 (Settimana 16, 62,6%; Settimana 52, 64,9%; Settimana 112, 63,0%) e sPGA 0/1 (Settimana 16, 84,2%; Settimana 52, 73,7%; Settimana 112, 73,5%).
“Questi dati di follow-up a due anni dimostrano l’efficacia duratura prodotta da deucravacitinib e la sua potenzialità di fornire un miglioramento clinicamente rilevante nel lungo termine nei pazienti affetti da psoriasi a placche da moderata a severa,” sostiene Jonathan Sadeh, MD, MSc, senior vice president of Immunology and Fibrosis Development, Bristol Myers Squibb. “In Bristol Myers Squibb, siamo impegnati a esplorare la scienza d’avanguardia per migliorare la cura delle persone affette da gravi malattie immuno-mediate e siamo focalizzati sul continuare la nostra ricerca su deucravacitinib e su altre nuove molecole del nostro vasto e differenziato portfolio”.
Bristol Myers Squibb ringrazia i pazienti e gli sperimentatori coinvolti nel programma di studio clinico POETYK PSO.
Il programma di studio clinico POETYK PSO
Gli studi POETYK (PrOgram to Evaluate the efficacy and safety of deucravacitinib, a selective TYK2 inhibitor) PSO-1 (NCT03624127) e POETYK PSO-2 (NCT03611751) sono studi globali di Fase 3 disegnati per valutare la sicurezza e l’efficacia di deucravacitinib, inibitore selettivo del TYK2, rispetto a placebo e apremilast nei pazienti con psoriasi a placche da moderata a severa. Sia il POETYK PSO-1, che ha arruolato 666 pazienti, che POETYK PSO-2, che ne ha arruolati 1.020, sono studi multicentrici, randomizzati, in doppio cieco per la valutazione di deucravacitinib (6 mg una volta al giorno) rispetto a placebo e apremilast (30 mg due volte al giorno). POETYK PSO-2 comprendeva una sospensione randomizzata e un periodo di ritrattamento dopo la settimana 24.
Gli endpoint co-primari di entrambi gli studi POETYK PSO-1 e POETYK PSO-2 erano la percentuale di pazienti che raggiungevano il Psoriasis Area and Severity Index (PASI) 75 e quella dei pazienti che raggiungevano uno static Physician’s Global Assessment (sPGA) di 0 o 1 (chiaro/quasi chiaro) alla settimana 16 rispetto al placebo. I principali enpoint secondari dello studio comprendevano la percentuale di pazienti che raggiungevano PASI 75 e il punteggio sPGA 0/1 rispetto ad apremilast alla settimana 16 e altri parametri di valutazione di deucravacitinib rispetto a placebo e apremilast.
Al termine delle 52 settimane degli studi POETYK PSO-1 e POETYK PSO-2, i pazienti potevano essere arruolati nello studio in corso POETYK PSO-LTE (NCT04036435) e ricevere in aperto deucravacitinib 6 mg una volta al giorno. Nello studio di estensione a lungo termine sono stati arruolati 1.221 pazienti e hanno ricevuto almeno una dose di deucravacitinib. L’efficacia è stata determinata utilizzando metodi di imputazione Treatment Failure Rules (TFR), insieme alla sensitivity analysis secondo l’imputazione modificata non-responder, e as-observed, utilizzate in analisi simili con altri farmaci. Oltre agli studi POETYK PSO-1, POETYK PSO-2 e POETYK PSO-LTE, Bristol Myers Squibb ha valutato deucravacitinib in due altri studi di Fase 3 nella psoriasi: POETYK PSO-3 (NCT04167462) e POETYK PSO-4 (NCT03924427).
I risultati dell’analisi primaria dello studio POETYK PSO-1 sono stati recentemente pubblicati nel Journal of the American Academy of Dermatology.
La psoriasi
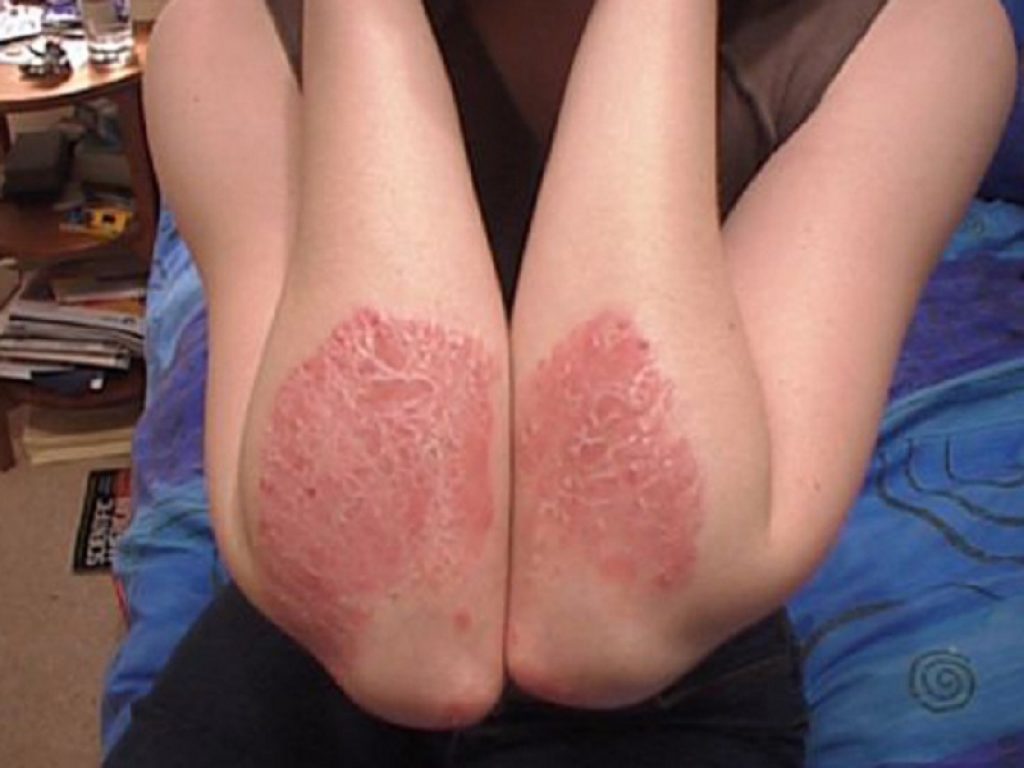
La psoriasi è una malattia sistemica cronica, immuno-mediata, ampiamente diffusa, che compromette sostanzialmente la salute dei pazienti, la qualità di vita e la produttività in ambito lavorativo. La psoriasi rappresenta un grave problema a livello globale, che vede almeno 100 milioni di persone in tutto il mondo colpite da qualche forma di questa malattia, di cui circa 14 milioni in Europa e 7,5 milioni negli Stati Uniti. Circa un quarto dei pazienti affetti da psoriasi presenta forme da moderate a severe. Fino al 90% dei pazienti con psoriasi presenta la forma volgare, o psoriasi a placche, caratterizzata da placche distinte ovali o rotonde tipicamente ricoperte da squame biancastre. Nonostante siano disponibili terapie sistemiche efficaci, molti pazienti con psoriasi da moderata a severa risultano trattati in modo non adeguato o addirittura non trattati e non sono soddisfatti delle attuali terapie. Le persone che soffrono di psoriasi riferiscono un impatto sul benessere emotivo, che condiziona le relazioni personali e professionali, causando un peggioramento della qualità di vita. La psoriasi è associata a diverse comorbidità che influiscono sul benessere dei pazienti, come l’artrite psoriasica, le malattie cardiovascolari, la sindrome metabolica, l’obesità, il diabete, le malattie infiammatorie intestinali e la depressione.
Deucravacitinib
Deucravacitinib è un inibitore allosterico selettivo della tirosin-chinasi 2 (TYK2) che fa parte della famiglia delle Janus chinasi (JAK). Deucravacitinib si lega al dominio regolatorio di TYK2, stabilizzando un’interazione inibitoria tra il dominio regolatorio e quello catalitico dell’enzima. Questo si traduce nell’inibizione allosterica dell’attivazione di TYK2 mediata dal recettore e dell’attivazione a valle di trasduttori di segnale e attivatori di trascrizione (STAT), come evidenziato in saggi cellulari. Le Janus chinasi funzionano come coppie di omo o eterodimeri nella via di segnalazione JAK-STAT. TYK2 si lega a JAK1 per mediare molteplici percorsi di citochine e si lega anche a JAK2 per trasmettere segnali, come dimostrato in alcuni saggi cellulari. Il meccanismo preciso che collega l’inibizione dell’enzima TYK2 all’efficacia terapeutica nel trattamento degli adulti con psoriasi a placche da moderata a severa non è attualmente noto.
Il 9 settembre 2022 la Food and Drug Administration americana ha approvato deucravacitinib per il trattamento dei pazienti adulti con psoriasi a placche da moderata a severa, candidati alla terapia sistemica o alla fototerapia. Deucravacitinib è inoltre in fase di revisione regolatoria da parte della European Medicines Agency e di altre autorità sanitarie nel mondo per il trattamento della psoriasi a placche da moderata a severa, e da parte del Japan’s Ministry of Health, Labour and Welfare per il trattamento dei pazienti adulti con psoriasi a placche da moderata a severa, psoriasi pustolosa e psoriasi eritrodermica.