Tumore al polmone non a piccole cellule: secondo i risultati dello studio di fase 2 PERLA, dostarlimab prevale nel confronto fra immunoterapici
![]()
Al congresso di Immuno-Oncologia della Società Europea di Oncologia Medica (ESMO-IO), a Ginevra, sono stati annunciati i risultati dello studio PERLA, in cui si è confrontato dostarlimab in combinazione con la chemioterapia rispetto a pembrolizumab in combinazione con la chemioterapia come trattamento di prima linea per i pazienti con carcinoma polmonare non a piccole cellule metastatico, con istologia non squamosa.
La combinazione di dostarlimab più la chemioterapia ha ottenuto risultati promettenti sia sul fronte dell’endpoint primario, rappresentato dal tasso di risposta obiettiva (ORR) confermato, sia su quello dell’endpoint secondario chiave, cioè la sopravvivenza libera da progressione (PFS) mediana.
PERLA è uno studio di fase 2 randomizzato, in doppio cieco, a cui hanno preso parte 243 pazienti ed è il più grande studio globale di confronto testa a testa mai condotto fra inibitori del recettore PD-1, in questa popolazione di pazienti.
«I dati head-to-head dello studio PERLA hanno dimostrato che dostarlimab in combinazione con la chemioterapia ha esercitato una solida attività antitumorale in pazienti con carcinoma polmonare non a piccole cellule metastatico, non trattati in precedenza. I risultati positivi di questo studio forniscono informazioni utili per i nostri futuri piani di sviluppo ed evidenziano il potenziale di dostarlimab come terapia immuno-oncologica fondamentale, sia come singolo agente sia in combinazione con gli standard di cura e con le terapie innovative della nostra pipeline», ha dichiarato Hesham Abdullah, Senior Vice President e Global Head of Oncology Development di GSK.
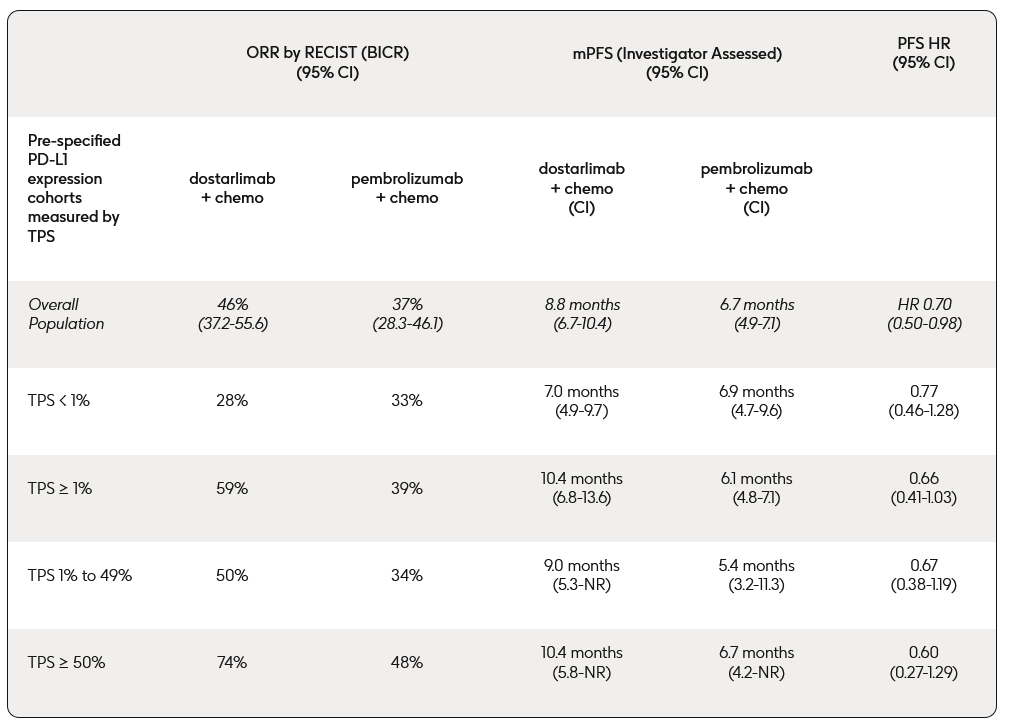
L’ORR complessivo, valutato secondo i criteri RECIST (Response Evaluation Criteria in Solid Tumours), mediante revisione centralizzata da revisori indipendenti in cieco (BICR), è risultato pari al 46% (56 pazienti su 121) nel braccio trattato con dostarlimab, contro 37% (45 pazienti su 122) nel braccio trattato con pembrolizumab (differenza nell’ORR: 9,32%; IC all’80% da 1,46% a 17,18%).
La PFS mediana è risultata di 8,8 mesi (IC al 95% da 6,7 a 10,4) nel braccio trattato con dostarlimab rispetto a 6,7 mesi (IC al 95% da 4,9 a 7,1) in quello assegnato a pembrolizumab (HR 0,70; IC al 95% da 0,50 a 0,98).
La tabella seguente riassume i risultati chiave in tutte i sottogruppi pre-specificati di pazienti stratificati in base all’espressione di PD-L1, misurato come Tumor Proportion Score (TPS).
Gli eventi avversi emergenti dal trattamento con dostarlimab nello studio PERLA sono risultati coerenti con quelli osservati in trial precedenti su regimi simili. L’incidenza di eventi avversi emergenti dal trattamento è risultata del 97% per entrambi i bracci di trattamento, mentre quella degli eventi avversi emergenti dal trattamento di grado 3 o superiore è risultata del 59% nel braccio di trattamento con dostarlimab e 60% nel braccio di trattamento con pembrolizumab. Gli eventi avversi emergenti dal trattamento più comuni sono stati anemia, astenia, nausea, costipazione, tosse, dispnea, vomito, diminuzione dell’appetito e neutropenia.
«Comprendere il ruolo dei trattamenti immuno-oncologici nei pazienti con tumore del polmone non a piccole cellule è un obiettivo importante che la comunità oncologica si è impegnata a raggiungere. Nonostante i progressi nelle opzioni terapeutiche, persistono bisogni insoddisfatti per gli operatori sanitari e i loro pazienti. I risultati dei dati presentati all’ESMO-IO si aggiungono al corpus di evidenze sugli agenti immuno-oncologici come dostarlimab e migliorano le nostre conoscenze in questa importante area di ricerca», ha dichiarato Solange Peters, a capo dell’Oncologia Medica dell’Ospedale Universitario di Losanna, in Svizzera, e Presidente dell’ESMO.
Lo studio PERLA
PERLA è un trial multicentrico internazionale, randomizzato, in doppio cieco, che ha coinvolto 243 pazienti e in cui si sono valutate efficacia e sicurezza di dostarlimab più la chemioterapia rispetto a pembrolizumab più la chemioterapia in pazienti con carcinoma polmonare non a piccole cellule metastatico, non squamoso, non portatori di mutazioni sensibilizzanti note di EGFR, di ALK o di RTK-1, o della mutazione V600E del gene BRAF o un’altra mutazione genomica per la quale è disponibile una terapia mirata approvata.
L’endpoint primario era l’ORR valutato mediante BICR secondo i criteri RECIST v1.1, mentre gli endpoint comprendevano la PFS valutata dallo sperimentatore secondo i criteri RECIST v1.1, la sopravvivenza globale (OS) e la sicurezza.