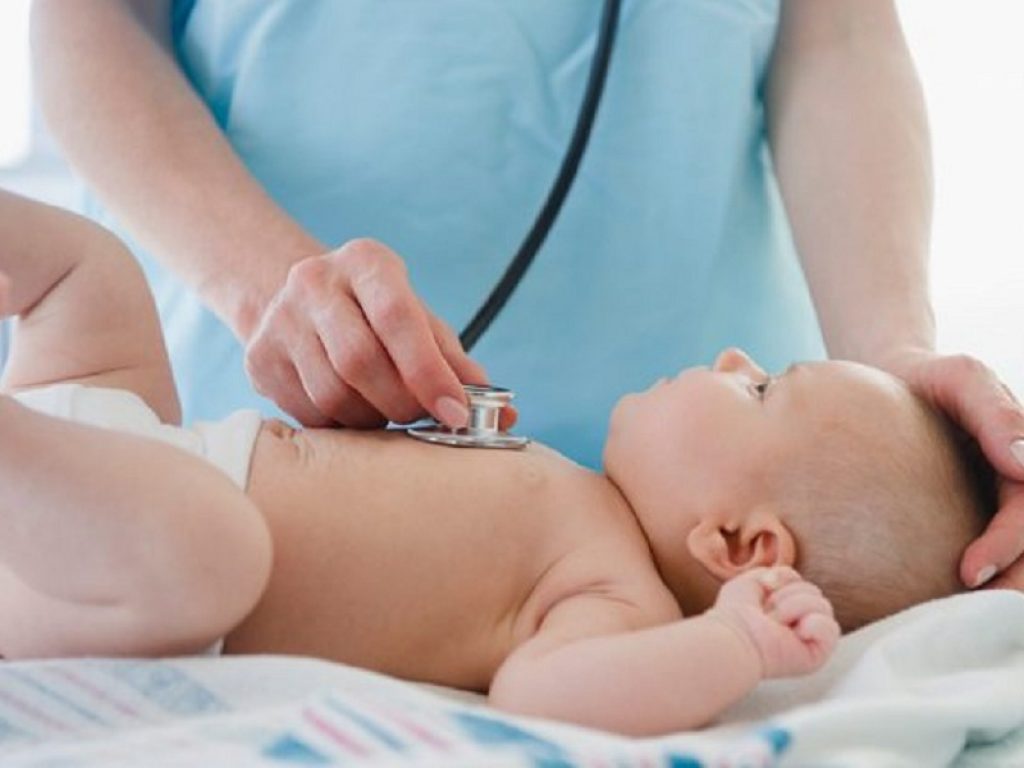
Il vaccino bivalente contro il virus respiratorio sinciziale di Pfizer ha dimostrato un’elevata efficacia contro la malattia grave delle basse vie respiratorie nei neonati
I dati principali dello studio di Fase III di Pfizer su RSVpreF, un vaccino bivalente contro il virus respiratorio sinciziale (RSV), hanno dimostrato un’elevata efficacia contro la malattia grave delle basse vie respiratorie (MA-lRTI) nei neonati, se somministrato durante il secondo o terzo trimestre di gravidanza.
Allo studio MATISSE hanno partecipato 7.400 donne in gravidanza di età pari o inferiore a 49 anni, che hanno ricevuto una singola iniezione di vaccino o un placebo. Nel primo dei due endpoint primari, la MA-lRTI grave, il vaccino ha dimostrato un’efficacia dell’81,8% nei neonati fino ai primi 90 giorni di vita.
Un’efficacia del 69,4% è stata mantenuta nel corso di un periodo di follow-up di sei mesi. Il secondo endpoint primario, l’efficacia clinicamente significativa per i casi di visite mediche, non è stato raggiunto. Sebbene Pfizer abbia riscontrato un’elevata efficacia, pari al 57,1%, l’ intervallo di confidenza era appena inferiore alla soglia FDA del 20%. Solo negli Stati Uniti, ogni anno si registrano quasi 2,1 milioni di visite mediche per RSV. Se questo vaccino venisse approvato, si potrebbe avere una diminuzione significativa delle visite.
Non sono stati osservati problemi di sicurezza per le madri o i neonati e il vaccino è stato ben tollerato. Il comitato di monitoraggio dei dati dello studio ha raccomandato a Pfizer di interrompere l’arruolamento nello studio e la Fda ha accettato. Sulla base dei risultati, l’azienda prevede di presentare alla Fda una richiesta di licenza biologica entro la fine dell’anno. A questa seguirà la presentazione alle autorità di regolamentazione di altri Paesi.
“Ogni anno assistiamo a livelli elevati di casi di RSV tra i bambini negli Stati Uniti e quest’anno alcune regioni hanno registrato tassi di ricovero ospedaliero superiori alla norma”, ha dichiarato Eric A.F. Simões, professore di pediatria e malattie infettive presso la University of Colorado School of Medicine e il Children’s Hospital Colorado di Aurora.
Il vaccino ha ricevuto a marzo la Breakthrough Therapy Designation dalla FDA per la prevenzione della malattia delle basse vie respiratorie associata all’RSV nei neonati fino a sei mesi di età attraverso l’immunizzazione attiva delle donne in gravidanza. Tale designazione si è basata sui dati dello studio di Fase IIb del vaccino proof-of-concept.
Nel novembre 2018, la FDA ha concesso al vaccino la designazione Fast Track. Altrove, nella pipeline RSV, Pfizer ha annunciato ad agosto dati positivi da un’analisi ad interim per lo studio di Fase III del vaccino RENOIR negli adulti di 60 anni e oltre. Lo studio è ancora in corso.