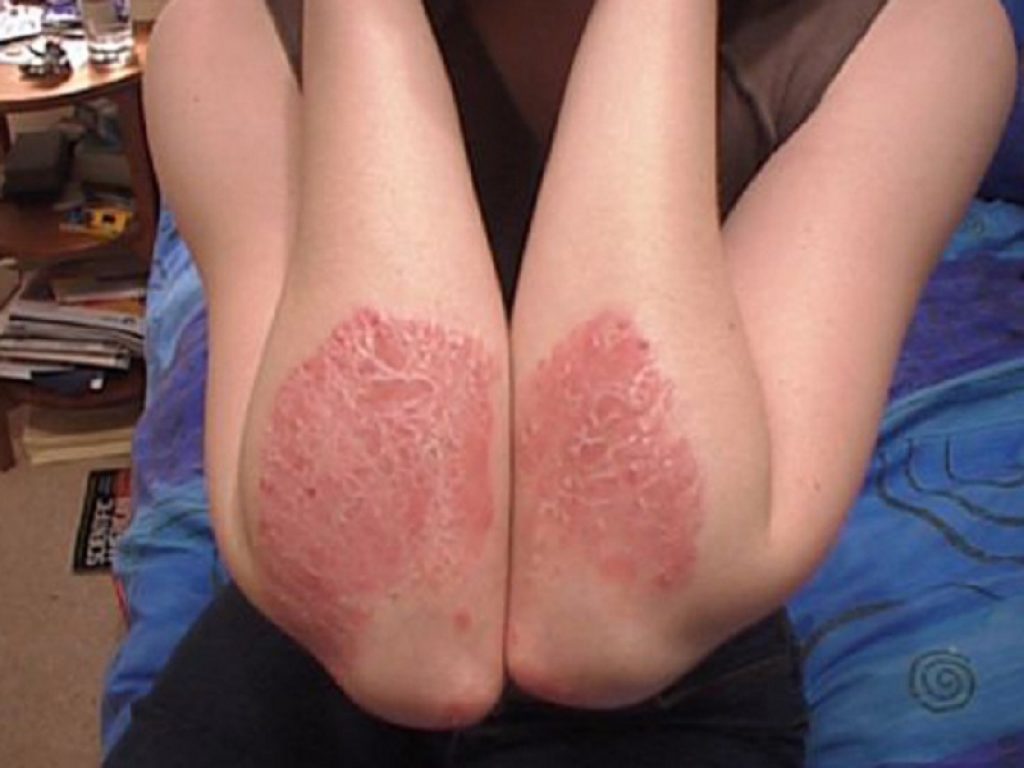
Nei pazienti con psoriasi a placche da moderata a grave, risultati incoraggianti per un peptide orale sperimentale antagonista del recettore dall’interleuchina-23
Nei pazienti con psoriasi a placche da moderata a grave un peptide orale sperimentale antagonista del recettore dall’interleuchina-23 ha raggiunto l’endpoint primario di riduzione della gravità della malattia in uno studio di fase IIb FRONTIER 1, secondo quanto comunicato dalla compagnia biotech sviluppatrice Protagonist Therapeutics.
«Siamo entusiasti di essere a questo punto di svolta con JNJ-2113, il primo e unico antagonista orale del recettore dell’interleuchina (IL)-23 come potenziale terapia orale mirata per la psoriasi a placche» ha osservato Dinesh Patel, presidente e Ceo dell’azienda. All’annuncio le azioni della società sono cresciute fino al 45%.
JNJ-2113 è un peptide antagonista orale del recettore della IL-23 (IL-23R) sviluppato dalla compagnia biotech, che nel luglio 2021 ha stipulato un accordo con l’unità Janssen Pharmaceuticals di Johnson & Johnson per sviluppare più antagonisti del recettore. Janssen ha offerto fino a 900 milioni di dollari al raggiungimento di determinati traguardi di sviluppo e vendita e si è impegnata a condurre tutti i futuri studi clinici.
Il gene IL-23R fornisce le istruzioni per produrre il recettore dell’interleuchina-23, una proteina incorporata nella membrana esterna di diversi tipi di cellule del sistema immunitario, comprese le cellule T, le cellule natural killer, i monociti e le cellule dendritiche. Sulla superficie cellulare il recettore interagisce con la IL-23, innescando una cascata di segnali chimici all’interno della cellula che promuovono l’infiammazione e aiutano a coordinare la risposta del sistema immunitario contro batteri e virus.
Raggiunto l’endpoint primario PASI 75 a 16 settimane
Lo studio FRONTIER 1, randomizzato, multicentrico, in doppio cieco e controllato con placebo, ha coinvolto 255 pazienti con psoriasi a placche da moderata a grave assegnati a ricevere uno tra tre dosaggi in singola somministrazione giornaliera di JNJ-2113, uno tra due dosaggi da assumere due volte al giorno oppure placebo.
I risultati principali hanno mostrato che, rispetto al placebo, una percentuale significativamente maggiore di pazienti che hanno ricevuto il trattamento attivo ha ottenuto un miglioramento del 75% delle lesioni cutanee misurate dallo Psoriasis Area and Severity Index (PASI 75) alla settimana 16 in tutti e cinque i gruppi di trattamento, soddisfacendo l’endpoint primario del trial.
Il farmaco è stato ben tollerato, senza che venissero osservate differenze significative nella frequenza di eventi avversi tra i gruppi di trattamento rispetto al placebo. I risultati dettagliati di FRONTIER 1 saranno presentati nel secondo trimestre del 2023 in occasione di un convegno medico.
Prossimo passo la fase III
Sulla base di questi dati si intende procedere con l’avvio di uno studio di registrazione di fase III nella psoriasi a placche e di valutare il potenziale del farmaco sperimentale in ulteriori malattie mediate dall’interleuchina-23.
JNJ-2113 è anche in fase di valutazione nello studio di estensione a lungo termine FRONTIER 2 di fase II. Inoltre il trial di fase IIa SUMMIT sta testando una formulazione in compresse a rilascio ritardato rispetto al placebo negli adulti con psoriasi a placche da moderata a grave.