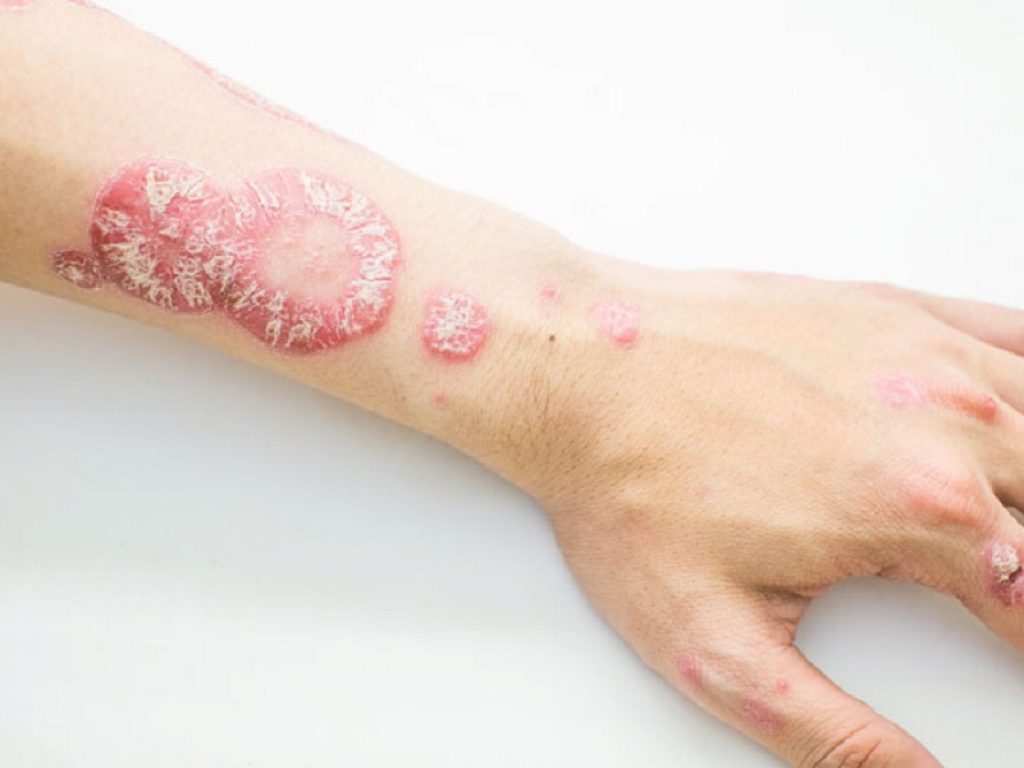
In oltre la metà dei pazienti con riacutizzazioni della psoriasi pustolosa generalizzata una singola dose di imsidolimab ha eliminato pustole, eritema e desquamazione
In oltre la metà dei pazienti con riacutizzazioni della psoriasi pustolosa generalizzata una singola dose endovenosa dell’anticorpo monoclonale sperimentale imsidolimab ha comportato una rapida eliminazione di pustole, eritema e desquamazione entro 4 settimane. Sono i risultati dello studio di fase III GEMINI-1 presentati dalla biotech sviluppatrice AnaptysBio.
Imsidolimab è un anticorpo IgG4 completamente umanizzato che inibisce la funzione del recettore dell’interleuchina (IL)-36 in fase di sviluppo per il trattamento della psoriasi pustolosa generalizzata (GPP), una malattia autoinfiammatoria sistemica rara, cronica e potenzialmente pericolosa per la vita se non trattata.
Durante una riacutizzazione della GPP nei pazienti si verifica l’eruzione improvvisa di pustole dolorose su ampie aree cutanee, accompagnate da arrossamento, forte prurito e pelle secca, screpolata o squamosa. Le persone affette dalla malattia possono anche presentare sintomi più generali come febbre, cefalea, estrema stanchezza o sensazione di bruciore sulla pelle.
Il programma di sviluppo clinico GEMINI
GEMINI-1 era un trial di fase III, randomizzato, in doppio cieco, controllato con placebo, della durata di quattro settimane, volto a valutare l’efficacia e la sicurezza di imsidolimab in pazienti con GPP, indipendentemente dallo stato mutazionale. È il primo studio a utilizzare l’endpoint composito Generalized Pustular Psoriasis Physician Global Assessment (GPPPGA) alla settimana 4 come primario. La valutazione GPPPGA, che rappresenta una caratterizzazione rigorosa e completa della gravità della malattia, richiedeva il raggiungimento di un punteggio complessivo di risposta clinica di 0/1 (pelle libera o quasi libera da lesioni) legato a più singoli fattori della malattia, inclusi pustole, eritema e desquamazione.
Ha arruolato un totale di 45 soggetti, randomizzati in rapporto 1:1:1 a ricevere una singola infusione di 750 mg di imsidolimab per via endovenosa, una singola infusione da 300 mg oppure placebo al giorno zero. I pazienti trattati con placebo che peggioravano o non miglioravano dopo il giorno 8 erano idonei alla terapia di salvataggio e al passaggio allo studio GEMINI-2 di fase III in cui hanno ricevuto una singola infusione di 750 mg di imsidolimab.
I pazienti che sono stati salvati o hanno completato lo studio GEMINI-1 saranno arruolati in GEMINI-2 nel quale riceveranno dosi mensili di 200 mg di imsidolimab sottocutaneo o placebo a seconda del grado di risposta o meno in GEMINI-1. Obiettivo dello studio, attualmente in corso, è valutare l’efficacia e la sicurezza dell’agente sperimentale per la prevenzione e/o la riduzione della gravità delle riacutizzazioni ricorrenti di GPP con somministrazione sottocutanea mensile per un periodo di tre anni.
Rapida risoluzione delle riacutizzazioni dopo una sola dose
Imsidolimab ha raggiunto l’endpoint primario ottenendo una rapida eliminazione della psoriasi pustolosa generalizzata durante la settimana 4 dopo una singola dose. Il 53,3% dei pazienti che hanno ricevuto una dose singola di imsidolimab da 750 mg per via endovenosa ha raggiunto un punteggio GPPPGA di 0/1 alla settimana 4 (endpoint primario), rispetto al 13,3% dei pazienti trattati con placebo (p=0,0131).
Inoltre il 66,7% dei soggetti nel gruppo placebo è uscito precocemente da GEMINI-1, è passato a GEMINI-2 ed era idoneo a ricevere la terapia di salvataggio con una singola dose di 750 mg di imsidolimab.
Il farmaco è stato ben tollerato fino alla fine dello studio. Tutti gli eventi avversi riportati nei pazienti in trattamento attivo sono stati lievi o moderati e bilanciati con quelli dei soggetti del gruppo placebo. Con imsidolimab non sono stati riportati eventi avversi gravi, casi di reazione al farmaco con eosinofilia e sintomi sistemici (DRESS) o sindrome di Guillain-Barré (GBS). L’incidenza di infezioni è stata bassa e non superiore rispetto al placebo. Uno dei 30 (3,3%) pazienti trattati con imsidolimab aveva anticorpi anti-farmaco rilevabili, che non erano neutralizzanti.
«La GPP è una malattia della pelle imprevedibile e potenzialmente pericolosa per la vita, con sintomi sistemici» ha affermato il professor Hervé Bachelez dell’Hôpital Saint-Louis di Parigi, uno dei maggiori esperti mondiali di GPP. «Il raggiungimento di risultati iniziali positivi utilizzando l’endpoint composito GPPPGA, insieme a un profilo di sicurezza convincente, mostra il potenziale di una singola dose di imsidolimab di fornire in modo prevedibile sollievo ai pazienti che convivono con questa grave malattia».