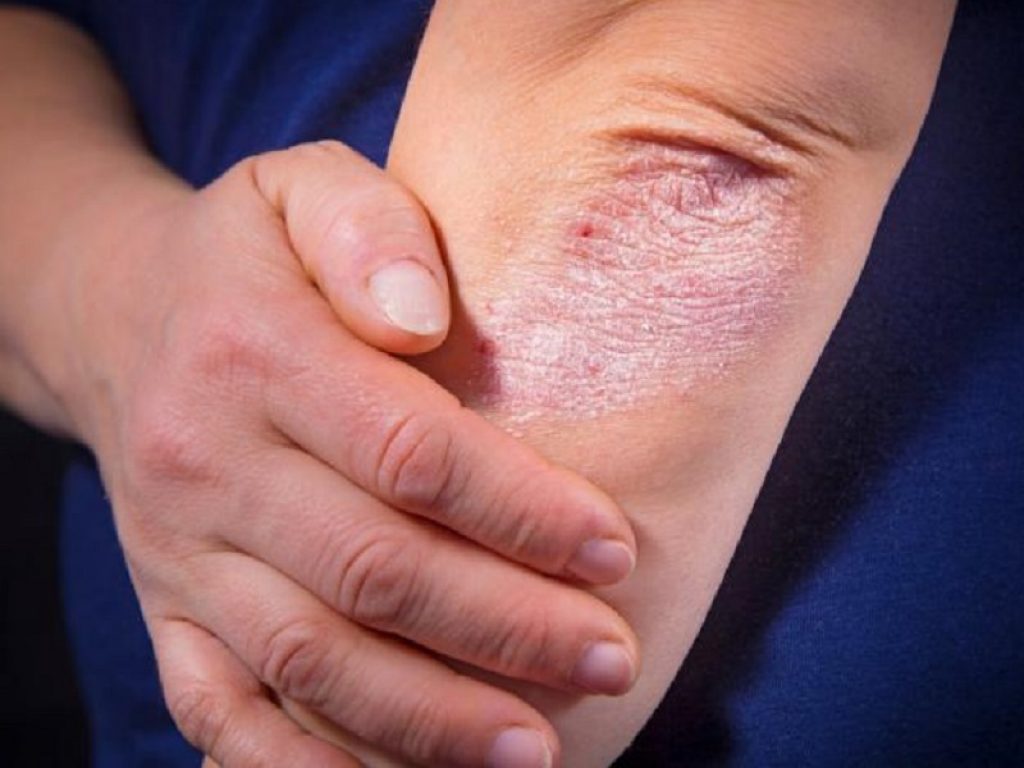
Nei pazienti con psoriasi a placche da moderata a grave, il trattamento con il peptide orale sperimentale JNJ-2113 ha dimostrato un’efficacia durevole fino a 52 settimane
Nei pazienti con psoriasi a placche da moderata a grave, il trattamento con il peptide orale sperimentale JNJ-2113 ha dimostrato un’efficacia durevole fino a 52 settimane, come evidenziato dai risultati dello studio FRONTIER 2 condivisi al congresso 2024 dell’American Academy of Dermatology (AAD).
JNJ-2113 (Johnson & Johnson) è il primo peptide orale progettato per bloccare il recettore dell’interleuchina (IL)-23, che svolge un ruolo fondamentale nell’attivazione delle cellule T patogene nella psoriasi a placche da moderata a grave e sostiene la risposta infiammatoria in questa e in altre malattie dermatologiche, reumatologiche e gastroenterologiche mediate dalla IL-23.
Lo studio di estensione a lungo termine FRONTIER 2
FRONTIER 2 è uno studio di fase IIb multicentrico, in doppio cieco, di estensione a lungo termine, con dosaggio variabile, volto a valutare l’efficacia e la sicurezza di JNJ-2113 per il trattamento della psoriasi a placche da moderata a grave. Lo studio ha valutato quattro dosaggi assunti per via orale una o due volte al giorno.
Nello studio originario (FRONTIER 1) 255 pazienti sono stati randomizzati in sei gruppi di trattamento, ovvero placebo (n=43), JNJ-2113 25 mg al giorno (n=43), 50 mg al giorno (n=43), 25 mg due volte al giorno (n=41), 100 mg al giorno (n= 43) e 100 mg due volte al giorno (n=43).
Alla settimana 16, un totale di 227 partecipanti di FRONTIER 1 sono entrati nello studio di estensione a lungo termine FRONTIER 2. I soggetti in trattamento attivo hanno continuato con lo stesso regime di dosaggio mentre quelli originariamente nel gruppo placebo hanno ricevuto JNJ-2113 alla dose di 100 mg una volta al giorno fino alla settimana 52.
L’efficacia si mantiene fino a un anno di trattamento
In FRONTIER 2, JNJ-2113 ha mantenuto tassi elevati di clearance cutanea per 52 settimane. Nei cinque gruppi di trattamento i tassi di risposta PASI (Psoriasis Area and Severity Index) si sono mantenuti dalla settimana 16 alla settimana 52, con una risposta PASI 75 (riduzione di almeno il 75% vs basale) più alta osservata nel gruppo trattato con 100 mg due volte al giorno (78,6% a 16 settimane e 76,2% a 52 settimane).
In modo simile all’endpoint primario, le risposte sono state mantenuto fino alla settimana 52 per tutti e cinque i gruppi di trattamento per gli endpoint secondari chiave PASI 90 (59,5% a 16 settimane e 64,3% a 52 settimane), PASI 100 (40,5% a 16 settimane e 40,5% a 52 settimane), punteggio di 0/1 (pelle libera o quasi libera da lesioni) nell’Investigator’s Global Assessment (IGA) (64,3% a 16 settimane e 73,8% a 52 settimane) e punteggio IGA pari a 0 (45,2% a 16 settimane e 42,9% a 52 settimane).
La sicurezza nello studio di estensione è risultata coerente con quanto già rilevato in FRONTIER 1. Nei gruppi di trattamento ha manifestato eventi avversi il 58,6% dei pazienti, senza evidenza di dipendenza dal dosaggio, prevalentemente rinofaringite (18,1%), infezione del tratto respiratorio superiore (9,7%) e COVID-19 (5,3%). Gli eventi avversi gravi erano rari e si sono verificati nel 4% dei soggetti trattati, non considerati non correlati al trattamento in studio.
«I risultati di FRONTIER 2 hanno dimostrato che la clearance cutanea osservata in base alle risposte PASI 75/90 e 100 a 16 settimane è stata mantenuta a 52 settimane senza nuovi segnali di sicurezza in tutti i gruppi di trattamento» ha affermato Laura Ferris, Professore di Dermatologia all’Università di Pittsburgh. «Suggeriscono il potenziale del farmaco per continuare a fornire risultati clinicamente significativi e rispondono all’elevata necessità insoddisfatta di un’opzione terapeutica orale nuova, durevole e conveniente per le persone che vivono con psoriasi a placche da moderata a grave».
Attualmente è in corso il programma di sviluppo clinico ICONIC di fase III per valutare la sicurezza e l’efficacia di JNJ-2113 negli adulti con psoriasi a placche da moderata a grave. I risultati dei trial FRONTIER 1 e 2 suggeriscono il potenziale del farmaco nell’intero spettro di ulteriori malattie mediate dalla IL-23, pertanto è stato anche avviato lo studio di fase IIb ANTHEM-UC nella colite ulcerosa attiva da moderata a severa.