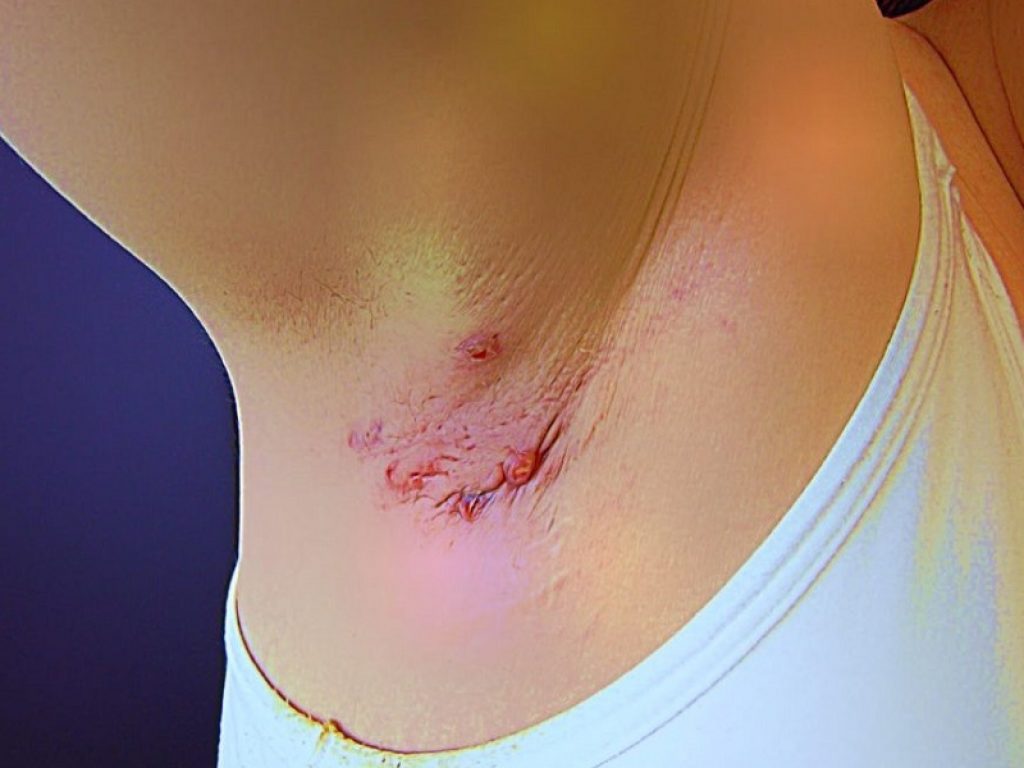
UCB ha ottenuto un’altra approvazione per bimekizumab: la Commissione Europea lo ha autorizzato per il trattamento dell’idrosadenite suppurativa
UCB ha ottenuto un’altra approvazione per bimekizumab: la Commissione Europea ha infatti autorizzato il doppio inibitore dell’IL-17A e dell’IL-17F per il trattamento dell’idrosadenite suppurativa (HS) attiva da moderata a grave negli adulti con una risposta inadeguata alla terapia sistemica convenzionale.
“Siamo orgogliosi di portare alla comunità dell’idrosadenite suppurativa il primo e unico farmaco approvato che ha come bersaglio IL-17A e IL-17F”, ha commentato Emmanuel Caeymaex, vicepresidente esecutivo delle soluzioni immunologiche, aggiungendo che l’autorizzazione segna “l’espansione di bimekizumab alla sua quarta indicazione approvata all’interno dell’UE”.
L’autorizzazione è stata concessa sulla base degli studi di Fase III BE HEARD I e BE HEARD II, che hanno dimostrato che alla 16a settimana bimekizumab ha portato a miglioramenti statisticamente significativi e clinicamente rilevanti rispetto al placebo, misurati dalla Risposta Clinica dell’Hidradenitis Suppurativa (HiSCR50), soddisfacendo gli endpoint primari. I benefici si sono mantenuti anche alla settimana 48.
Bimekizumab è autorizzato in Europa anche per la psoriasi a placche, l’artrite psoriasica e la spondiloartrite assiale. Il farmaco è stato autorizzato negli Stati Uniti alla fine dello scorso anno per la psoriasi a placche, dopo aver subito in precedenza ritardi normativi dovuti a carenze in uno stabilimento di produzione belga. La Fda sta esaminando le richieste di autorizzazione per l’artrite psoriasica, la spondiloartrite assiale non radiografica, la spondilite anchilosante e l’HS.
L’HS è una malattia infiammatoria della pelle cronica e recidivante che si manifesta con noduli, ascessi e fistole con fuoriuscita di pus, cioè canali che fuoriescono dalla pelle, tipicamente nelle ascelle, nell’inguine e nei glutei. L’HS inizia tipicamente nella prima età adulta e colpisce circa l’uno per cento della popolazione nella maggior parte dei Paesi studiati. L’HS è associata a significative comorbilità e può avere un profondo effetto negativo sulla qualità di vita dei pazienti.
“L’idrosadenite suppurativa può avere un impatto devastante sulle persone, soprattutto su quelle con malattia da moderata a grave. Oltre ai sintomi fisici, per molte persone può esserci anche un notevole peso psicologico, che si traduce in una riduzione della qualità della vita e nella mancata partecipazione a eventi importanti”, ha dichiarato Barry McGrath, cofondatore di HS Ireland, un’associazione per tutte le persone affette da idrosadenite suppurativa in Irlanda. “La possibilità di una nuova opzione terapeutica per aiutare le persone che vivono con questa malattia è molto gradita”.
Informazioni su BE HEARD I e BE HEARD II1
BE HEARD I e BE HEARD II sono studi di Fase 3 multicentrici, randomizzati, in doppio cieco, controllati con placebo, volti a valutare l’efficacia e la sicurezza di bimekizumab negli adulti affetti da L’idrosadenite suppurativa (HS) da moderata a grave. I due studi hanno arruolato complessivamente 1.014 pazienti adulti con una diagnosi di HS da moderata a grave. L’endpoint primario in entrambi gli studi era HiSCR50 alla 16a settimana. Un endpoint secondario chiave era l’HiSCR75 alla 16a settimana. HiSCR50 e HiSCR75 sono definiti come una riduzione di almeno il 50 o il 75% rispetto al basale della conta totale degli ascessi e dei noduli infiammatori, senza alcun aumento rispetto al basale della conta degli ascessi o dei tunnel drenanti.
I risultati di BE HEARD I e BE HEARD II hanno mostrato che una percentuale significativamente più alta di pazienti trattati con bimekizumab rispetto al placebo ha ottenuto un miglioramento del 50% o più dei segni e dei sintomi di HS alla settimana 16, come misurato dall’HiSCR50, l’endpoint primario in entrambi gli studi. Il trattamento con bimekizumab ha anche determinato miglioramenti clinicamente significativi nell’endpoint secondario chiave classificato, HiSCR75, rispetto al placebo alla settimana 16. Le risposte sono state mantenute fino alla settimana 48. Le risposte sono state mantenute fino alla settimana 48.
Il profilo di sicurezza di bimekizumab è risultato coerente con i dati di sicurezza osservati negli studi precedenti, senza nuovi segnali di sicurezza osservati.