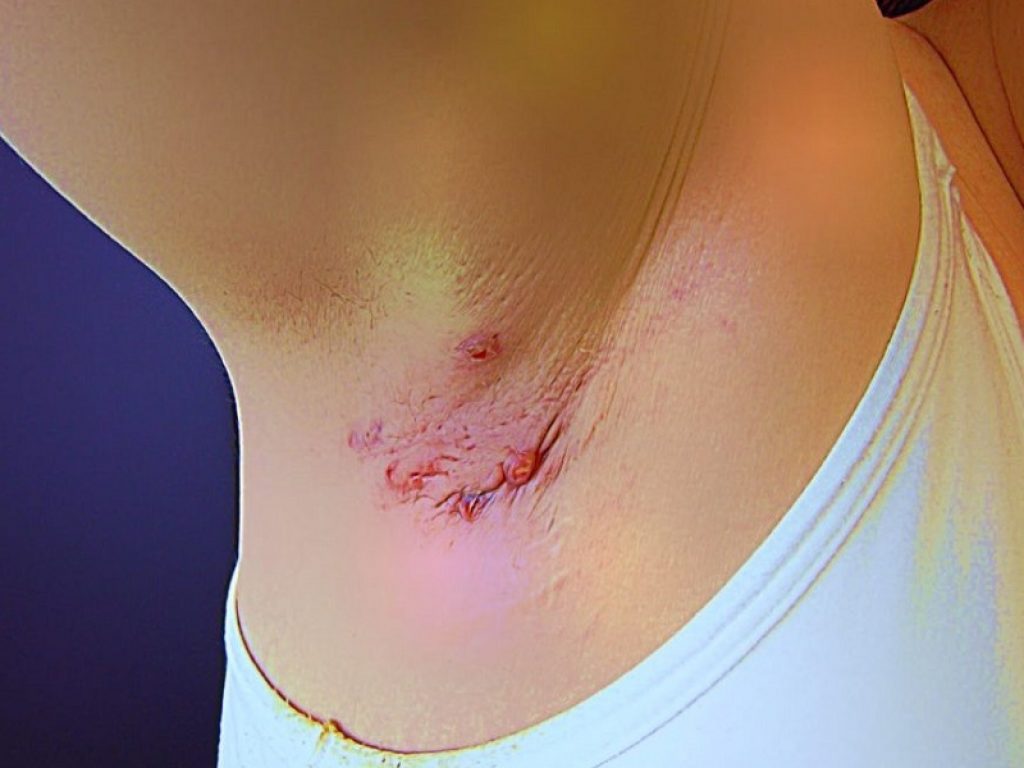
Nei pazienti affetti da idrosadenite suppurativa il trattamento con l’inibitore sperimentale dell’interleuchina-17A izokibep ha consentito una notevole riduzione della gravità della malattia
Nei pazienti affetti da idrosadenite suppurativa il trattamento con l’inibitore sperimentale dell’interleuchina-17A izokibep ha consentito una notevole riduzione della gravità della malattia in una quota di pazienti significativamente superiore rispetto al placebo dopo 12 settimane, come emerso dai risultati di uno studio di fase III in corso.
L’idrosadenite suppurativa è una malattia infiammatoria cronica della pelle che interessa generalmente aree cutanee con elevate concentrazioni di ghiandole sudoripare ed è solitamente accompagnata da dolore, cattivo odore, drenaggio e deturpazione che contribuiscono alla disabilità e a un forte impatto sulla qualità della vita. I pazienti che ne soffrono perdono un numero maggiore di giorni di lavoro e hanno una maggiore disabilità rispetto alla popolazione media.
Izokibep è una piccola proteina terapeutica a somministrazione sottocutanea progettata per inibire l’interleuchina (IL)-17A con elevata potenza attraverso una forte affinità di legame, disegnata per superare i limiti degli anticorpi monoclonali. Ha il potenziale per penetrare efficacemente nei tessuti grazie alle sue piccole dimensioni molecolari, circa un decimo di un anticorpo monoclonale, e un dominio di legame all’albumina che ne migliora le proprietà farmacocinetiche e l’emivita.
I dati degli studi clinici supportano l’ipotesi che queste caratteristiche uniche di izokibep possano fornire benefici clinicamente significativi e differenziati per i pazienti, tra cui la risoluzione delle principali manifestazioni della malattia. Il farmaco è stato somministrato a più di mille pazienti, alcuni dei quali sono stati trattati per più di tre anni, ed è in fase di valutazione in più studi in fase avanzata su idrosadenite suppurativa da moderata a grave, artrite psoriasica e uveite.
Risponde sempre più profonde prolungando il trattamento
Lo studio globale di fase III nell’idrosadenite suppurativa ha confermato il raggiungimento di risposte statisticamente significative in molteplici endpoint di efficacia a 12 settimane. Il 33% dei pazienti che hanno ricevuto izokibep 160 mg alla settimana ha raggiunto l’endpoint primario di riduzione di almeno il 75% rispetto al basale nel conteggio totale di ascessi e noduli infiammatori senza aumento di ascessi e fistole drenanti rispetto al basale (Hidradenitis Suppurativa Clinical Response, HiSCR 75) rispetto al 21% dei pazienti che hanno ricevuto placebo (p=0,0294).
Negli endpoint di ordine superiore, il 25% dei pazienti trattati con izokibep ha raggiunto una risposta HiSCR 90 rispetto al 9% con il placebo (p=0,0009) e il 22% ha raggiunto la risposta HiSCR 100 rispetto all’8% con il placebo (p=0,001).
L’endpoint primario è stato misurato a 12 settimane e i pazienti in studio hanno continuato a ricevere un dosaggio controllato con placebo fino alla settimana 16. I dati preliminari dei due terzi dei partecipanti che hanno completato la settimana 16 dimostrano ulteriormente l’approfondimento delle risposte con izokibep nel tempo, dove il 40% dei pazienti in trattamento attivo ha raggiunto la risposta HiSCR 75 in confronto al 20% con il placebo (p<0,05).
Negli endpoint di ordine superiore il 27% dei pazienti in trattamento attivo ha raggiunto la risposta HiSCR 90 rispetto al 13% con il placebo (p<0,05) e il 25% ha raggiunto la risposta HiSCR 100 rispetto al 10% con il placebo (p<0,05).
Il farmaco sperimentale è stato ben tollerato, con un profilo di sicurezza favorevole coerente con la precedente esperienza con izokibep e la classe degli inibitori della IL-17A, senza nuovi segnali di sicurezza. In particolare non ci sono stati casi di infezione da candida, tossicità epatica o ideazione/comportamento suicidario nel braccio attivo.
Le risposte più profonde osservate alla settimana 16, con un quarto dei pazienti che ha raggiunto la risposta HiSCR 100, fa presumere risposte ancora migliori proseguendo il trattamento. Secondo Affibody, la compagnia sviluppatrice del prodotto, questi risultati dimostrano che il targeting della sola IL-17A con una maggiore potenza può consentire di ottenere risposte cliniche simili o anche superiori rispetto agli agenti che prendono di mira le subunità dell’interleuchina in modo più ampio, con un minore impatto sulla sicurezza.